Презентація на тему: способи вираження концентрації розчинів. Конспект уроку з Хімії "Способи вираження складу розчину
Презентація може використовуватися на уроці хімії у 11 класі, частково у 8 класі, під час проведення елективного курсу. У презентації міститься інформація про наступні способи вираження концентрації розчинів: масова частка, молярність, моляльність, мольна частка, титр.
Завантажити:
Попередній перегляд:
Щоб скористатися попереднім переглядом презентацій, створіть собі обліковий запис Google і увійдіть до нього: https://accounts.google.com
Підписи до слайдів:
Що позначається цими величинами хімії? ω , Див, X
Тема уроку: «Способи вираження концентрацій розчинів»
Цілі уроку: розширити та систематизувати уявлення про способи вираження концентрації розчинів; вивчити нові способи вираження концентрацій розчинів; вчитися застосовувати отримані теоретичні знання під час вирішення завдань; розвивати інтелектуальні вміння та навички.
Концентрація – величина, що характеризує кількісний склад розчину. Згідно з правилами ІЮПАК, концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або її маси до обсягу розчину (моль/л, г/л), тобто це співвідношення неоднорідних величин. Ті величини, які є відношенням однотипних величин (відношення маси розчиненої речовини до маси розчину, відношення об'єму розчиненої речовини до об'єму розчину) правильно називати частками. Однак на практиці для обох видів виразу складу застосовують термін концентрація і говорять про концентрацію розчинів.
Способи вираження концентрації розчинів 1 Масова частка (вагові відсотки, процентна концентрація) 2 Об'ємна частка 3 Молярність (молярна концентрація) 4 Мольна частка 5 Моляльність (моляльна концентрація) 6 Титр розчину 7 Нормальність (молярна концентрація еквівалента) 8 Розчинність речовини
Процентна концентрація, масова частка розчиненої речовини Масова частка розчиненої речовини - це відношення маси розчиненої речовини до маси розчину. Для розрахунку процентної концентрації використовується формула: Розчин складається з розчиненої речовини та розчинника. Масу розчину можна визначити за формулою:
У бінарних розчинах часто існує однозначна залежність між щільністю розчину та його концентрацією (при цій температурі). Це дає можливість визначати практично концентрації важливих розчинів з допомогою денсиметра (спиртометра, сахариметра, лактометра). Деякі ареометри проградуйовані над значеннях щільності, а безпосередньо концентрації розчину (спирту, жиру в молоці, цукру). Часто для вираження концентрації (наприклад, сірчаної кислоти в акумуляторах) користуються їх щільністю. Поширені ареометри призначені визначення концентрації розчинів речовин.
Залежність щільності розчинів H 2 SO 4 від її масової частки у водному розчині при 20°C ω, % 10 30 50 70 80 90 ρ H 2 SO 4 , г/мл 1,066 1,219 1,395 1,611 1,72
Об'ємна частка Об'ємна частка - відношення об'єму розчиненої речовини до об'єму розчину. Об'ємна частка вимірюється у частках одиниці чи у відсотках. де: V (в-ва) – обсяг розчиненої речовини, л; V(р-ра) – загальний обсяг розчину, л. Як було зазначено вище, існують ареометри, призначені визначення концентрації розчинів певних речовин. Такі ареометри проградуйовані над значеннях щільності, а безпосередньо концентрації розчину. φ = V(в-ва) V(р-ра)
Молярність (молярна концентрація) Молярність – число молей розчиненої речовини в одиниці об'єму розчину. де - кількість розчиненої речовини, моль; V - об'єм розчину, л Молярність частіше виражають у моль/л або ммоль/л. Можливі такі позначення молярної концентрації - З, См, М. Так, розчин із концентрацією 0,5 моль/л називають 0,5-молярним (0,5М).
Мольна частка (X) - відношення кількості молей даного компонента до загальної кількості молей усіх компонентів. Мольну частку виражають у частках одиниці. X = ν (в-ва) \ ∑ ν (в-в) ν – кількість компонента, моль; ∑ ν – сума кількостей всіх компонентів, моль.
Моляльність (моляльна концентрація) Моляльність – число молей розчиненої речовини в 1кг розчинника. Вимірюється в моль/кг, Так, розчин із концентрацією 0,5 моль/кг називають 0,5-моляльним. Св = ν / m(р-ля), де: ν - кількість розчиненої речовини, моль; m (р-ля) – маса розчинника, кг. Слід звернути особливу увагу, що незважаючи на схожість назв, молярність та моляльність величини різні. Насамперед, при вираженні концентрації в моляльності, на відміну молярності, розрахунок ведуть на масу розчинника, а чи не обсяг розчину. Моляльність, на відміну молярності, залежить від температури.
Титр розчину Титр розчину – маса розчиненої речовини в 1 мл розчину. Т = m (в-ва) / V (р-ра), де: m (в-ва) - маса розчиненої речовини, г; V(р-ра) – загальний обсяг розчину, мл; В аналітичній хімії зазвичай концентрацію титранта перераховують стосовно конкретної реакції титрування таким чином, щоб обсяг використаного титранта безпосередньо показував масу визначається речовини; тобто титр розчину показує, якій масі речовини, що визначається (в грамах) відповідає 1 мл титрованого розчину.
Нормальність (молярна концентрація еквівалента) Нормальність (Сн) – число еквівалентів даної речовини в одному літрі розчину. Нормальність виражають у моль-екв/л. Часто концентрацію таких розчинів виражають як н. Наприклад, розчин, що містить 0,1 моль-екв/л, називають децинормальним і записують як 0,1н. Сн = Е/V (р-ра), де: Е – еквівалент, моль-екв; V – загальний обсяг розчину, л; Сн(луги) ∙V(луги)= Сн(кислоти)∙ V(кислоти)
Коефіцієнт розчинності Дуже часто концентрацію насиченого розчину, поряд з перерахованими характеристиками, виражають через так званий коефіцієнт розчинності або просто розчинність речовини. Відношення маси речовини, що утворює насичений розчин при даній температурі, до маси розчинника називають коефіцієнтом розчинності: Кр = m (в-ва) / m (р-ля) Розчинність речовини показує максимальну масу речовини, яка може розчинитися в 100 г розчинника: р = (m в-ва / m р-ля) ∙ 100%
Завдання 1. Визначте молярну концентрацію хлориду натрію в 24% розчині його щільністю 1,18 г/мл. (Відповідь - 4,84 М) 2. Визначте молярну концентрацію соляної кислоти в 20% розчині щільністю 1,098. (Відповідь - 6М) 3. Визначте молярну концентрацію азотної кислоти в 30% розчині її щільністю 1,18 г/мл. (Відповідь - 5,62 М) 4. Обчисліть масову частку гідроксиду калію у водному розчині з концентрацією 3М та щільністю 1,138 г/мл. (Відповідь - 15%) 5. Скільки мл 56% розчину сірчаної кислоти (щільність-1,46г/мл) потрібно для приготування 3 л 1М розчину? (Відповідь – 360 мл)
6. До води масою 200 г долили 2М розчин калію хлориду об'ємом 40 мл і щільністю 1,09 г/мл. Визначте молярну концентрацію та масову частку солі в отриманому розчині, якщо його щільність дорівнювала 1,015 г/мл. (Відповідь – 0,33М, 2,45%) 7. Скільки г гідроксиду калію потрібно для нейтралізації 300 мл 0,5 М розчину сірчаної кислоти? (Відповідь - 16,8 г) 8. Який об'єм 2 М розчину гідроксиду калію вступить у реакцію: а) з 49 г сірчаної кислоти; б) з 200 г 24,5%-ного розчину сірчаної кислоти? В) із 50 г 6,3%-ного розчину азотної кислоти? 9. Який об'єм 3М розчину хлориду натрію щільністю 1,12 г/мл треба прилити до води масою 200 г, щоб одержати розчин із масовою часткою солі 10%? (Відповідь - 315 мл) 10. Який об'єм 3М розчину хлориду калію знадобиться для приготування 200 мл 8%-ного розчину солі з щільністю 1,05 г/мл? (Відповідь – 75,2 мл) 11. 2,8 л аміаку розчинили у воді, об'єм розчину довели до 500 мл. Яка кількість речовини аміаку міститься в 1 л такого розчину? (Відповідь – 0,25 моль)
Розчини. Розчинами називають гомогенні системи, у яких одна речовина розподілена серед іншого (інших) речовин. Якщо одним із складових розчинів речовин є рідина, іншими - гази чи тверді речовини, то розчинником зазвичай вважають рідину. В інших випадках розчинником вважають компонент, якого більше. Розчин Розчинник Розчинена речовина
Розчини. Класифікація розчинів. Тверді Рідкі Газоподібні Агрегатний стан Грубодисперсні системи Колоїдні розчини Справжні розчини Ступінь дисперсності Ненасичені Насичені Пересичені Розчинність Розведені Концентровані Кількість розчиненої речовини

Розчини. Розчинення. Розчинення - це мимовільний розподіл частинок однієї речовини між частинками іншої. Під впливом розчинника руйнується кристалічна решітка твердої речовини, а іони рівномірно розподіляються по всьому об'єму розчинника.

Розчини. Ненасичений розчин - це розчин, в якому при даних температурі і тиску можливе подальше розчинення речовини, що вже міститься в ньому. Розчин, у якому речовина за цієї температури більше не розчиняється, тобто. розчин, що знаходиться в стані рівноваги з твердою фазою речовини, що розчиняється, називається насиченим. Пересичений розчин, розчин, концентрація речовини в якому вище концентрації насиченого розчину (при даних температурі та тиску). Пересичені розчини дуже нестійкі. Легкий струс судини або введення в розчин кристалів речовини, що знаходиться в розчині, викликає кристалізацію надлишку розчиненої речовини і розчин стає насиченим.

Розчини. Фізична та хімічна теорія розчинів. Фізична теорія запропонована В. Оствальдом (Німеччина) та С. Арреніусом (Швеція). частинки розчинника та розчиненої речовини (молекули, іони) рівномірно розподіляються по всьому об'єму розчину внаслідок процесів дифузії. При цьому між розчинником та розчиненою речовиною відсутня хімічна взаємодія. Хімічну теорію запропоновано Д.І. Менделєєвим. між молекулами речовини, що розчиняється, і розчинником відбувається хімічна взаємодія з утворенням нестійких, що перетворюються одна в одну сполук розчиненої речовини з розчинником - сольватів. Фізико-хімічна теорія Російські вчені І.А. Каблуков та В.А. Кістяковський об'єднали уявлення Оствальда, Арреніуса та Менделєєва Відповідно до сучасної теорії в розчині можуть існувати не тільки частинки розчиненої речовини та розчинника, але й продукти фізико-хімічної взаємодії розчиненої речовини з розчинником – сольвати. Сольвати – це нестійкі сполуки змінного складу. Якщо розчинником є вода, їх називають гідратами. Сольвати (гідрати) утворюються за рахунок іондипольної, донорно-акцепторної взаємодій, утворення водневих зв'язків тощо.

Розчини. Розчинність. Розчинність залежить від природи розчиненої речовини та розчинника, а також від зовнішніх умов (температури, тиску). Залежність розчинності від природи розчиненої речовини та розчинника Розчинність твердих речовин у рідинах залежить від типу зв'язку в їх кристалічних ґратах. Наприклад, речовини з атомними кристалічними гратами (вуглець, алмаз та ін.) Мало розчинні у воді. Речовини з іонними кристалічними ґратами, як правило, добре розчиняються у воді. Речовини з іонним чи полярним типом зв'язку добре розчиняються у полярних розчинниках. Наприклад, солі, кислоти, спирти добре розчиняються у воді. У той же час неполярні речовини зазвичай добре розчиняються в неполярних розчинниках. Розчинність газів у рідинах також залежить від їхньої природи. Наприклад, у 100 об'ємах води при 20oС розчиняється 2 об'єми водню, 3 об'єми кисню. У тих самих умовах у 1 обсязі Н2О розчиняється 700 об'ємів аміаку.

Розчини. Вплив температури на розчинність. При розчиненні газів у воді внаслідок гідратації молекул розчиняється виділяється теплота. Тому відповідно до принципу Ле Шательє у разі підвищення температури розчинність газів знижується. Температура по-різному впливає на розчинність твердих речовин у воді. Найчастіше розчинність твердих речовин зростає з підвищенням температури. Найчастіше взаємна розчинність рідин також зростає з підвищенням температури.

Розчини. Вплив тиску на розчинність. На розчинність твердих і рідких речовин у рідинах тиск практично не впливає, оскільки зміна обсягу при розчиненні невелика. При розчиненні газоподібних речовин рідини відбувається зменшення обсягу системи, тому підвищення тиску призводить до збільшення розчинності газів. У загальному вигляді залежність розчинності газів від тиску підпорядковується закону У. Генрі (Англія, 1803): розчинність газу при постійній температурі прямо пропорційна його тиску над рідиною. Закон Генрі справедливий лише при невеликих тисках для газів, розчинність яких порівняно невелика і за умови відсутності хімічної взаємодії між молекулами газу, що розчиняється, і розчинником.

Розчини. Концентрація розчинів. 1. Масова частка (або відсоткова концентрація речовини) – це відношення маси розчиненої речовини m до загальної маси розчину. Для бінарного розчину, що складається з розчиненої речовини та розчинника: де: ω – масова частка розчиненої речовини; m в-ва – маса розчиненої речовини; m р-ну – маса розчинника. Масову частку виражають у частках від одиниці чи відсотках.

Розчини. Концентрація розчинів. 2. Молярна концентрація або молярність – це кількість молей розчиненої речовини в одному літрі розчину V: де: C – молярна концентрація розчиненої речовини, моль/л (можливе також позначення М, наприклад, 0,2 М HCl); n – кількість розчиненої речовини, моль; V – об'єм розчину, л. Розчин називають молярним або однополярним, якщо в 1 літрі розчину розчинено 1 моль речовини, децимолярним – розчинено 0,1 моля речовини, сантимолярним – розчинено 0,01 моля речовини, мілімолярним – розчинено 0,001 моля речовини.

Розчини. Концентрація розчинів. 3. Моляльна концентрація (моляльність) розчину С(x) показує кількість молей n розчиненої речовини в 1 кг розчинника m: де С (x) – моляльність, моль/кг; n – кількість розчиненої речовини, моль; m р-ля – маса розчинника, кг.


Розчини. Концентрація розчинів. 5. Мольна частка розчиненої речовини – безрозмірна величина, що дорівнює відношенню кількості розчиненої речовини n до загальної кількості речовин у розчині: де: N – мольна частка розчиненої речовини; n – кількість розчиненої речовини, моль; n р-ля – кількість речовини розчинника, моль. Сума мольних часток повинна дорівнювати 1: N(X) + N(S) = 1. де N(X) - мольна частка розчиненої речовини Х; N(S) - мольна частка розчиненої речовини S. Іноді при вирішенні завдань необхідно переходити від одних одиниць виразу до інших: ω(X) - масова частка розчиненої речовини, %; М(Х) – молярна маса розчиненої речовини; ρ= m/(1000V) – густина розчину

Розчини. Концентрація розчинів. 6. Нормальна концентрація розчинів (нормальність або молярна концентрація еквівалента) – число грам-еквівалентів цієї речовини в одному літрі розчину. Грам-еквівалент речовини – кількість грамів речовини, чисельно рівну його еквіваленту. Еквівалент - це умовна одиниця, рівноцінна одному іону водню в кислотно-основних реакціях або одному електрону в окислювально-відновних реакціях. Для запису концентрації таких розчинів використовують скорочення або N. Наприклад, розчин, що містить 0,1 моль-екв/л, називають децинормальним і записують як 0,1 н. де: СН – нормальна концентрація, моль-екв/л; z – число еквівалентності; V р-ну – об'єм розчину, л.

Розчини. Концентрація розчинів. Розчинність речовини S - максимальна маса речовини, яка може розчинитись у 100 г розчинника: Коефіцієнт розчинності – відношення маси речовини, що утворює насичений розчин при конкретній температурі, до маси розчинника:

§ 1 Способи вираження концентрації розчинів
Спробуємо уявити два розчини. Один приготований шляхом розчинення однієї столової ложки солі у склянці води, другий – столової ложки солі у ванні з водою.
Чи відрізнятимуться ці розчини? Зрозуміло, так. Перший розчин буде солонішим на смак, закипить при більш високій і замерзне при нижчій температурі, ніж другий розчин. І хімічні реакції з першим розчином протікатимуть інтенсивніше, ніж із другим. Таким чином, співвідношення кількості розчиненої речовини з кількістю розчинника (тобто концентрація) визначають властивості розчину.
Розчини бувають концентровані (з високим вмістом розчиненої речовини) та розбавлені (з низьким вмістом розчиненої речовини).
Це якісна оцінка концентрації розчинів, застосовувати яку можна дуже умовно. Набагато більший інтерес мають різні кількісні способи вираження концентрації розчинів.
Концентрацію речовини можна виразити в молях розчиненої речовини на 1 літр розчину. Така концентрація називається молярною і позначається латинською великою літерою С.
Молярна концентрація дорівнює відношенню кількості речовини в молях υ до об'єму розчину в літрах V. Виражається вона в молях на літр.
Концентрацію розчину часто виражають у масових частках.
Масовою часткою розчиненої речовини називають відношення маси розчиненої речовини до загальної маси розчину.
Масову частку розчиненої речовини позначають грецькою літерою?

Масова частка ω речовини дорівнює відношенню маси речовини m до маси розчину mр. Масову частку можна виражати у частках від одиниці чи у відсотках, у разі результат множиться на 100%.
§ 2 Розв'язання задач на тему уроку
Розв'яжемо завдання. Після повного випаровування 50 г розчину утворилося 6 г твердого залишку. Обчисліть масову частку розчиненої речовини у розчині.

За заданою масовою часткою розраховують кількості інгредієнтів для приготування розчинів.
Наприклад, необхідно приготувати 150 г 10%-го розчину хлориду натрію, тобто потрібно знайти, скільки для цієї мети необхідно солі та води.

Відповідь: для приготування розчину потрібно 15 г хлориду натрію та 135 г води.
Список використаної литературы:
- Н.Є. Кузнєцова. Хімія. 8 клас. Підручник для загальноосвітніх установ. - М. Вентана-Граф, 2012.
Використані зображення:
Що позначається цими величинами хімії?
Виконала вчитель хімії МБОУ Климівської ЗОШ №1 Буданкова Валентина Михайлівна


- розширити та систематизувати уявлення про способи вираження концентрації розчинів;
- вивчити нові способи вираження концентрацій розчинів;
- вчитися застосовувати отримані теоретичні знання під час вирішення завдань;
- розвивати інтелектуальні вміння та навички.

Концентрація - Величина, що характеризує кількісний склад розчину.
Згідно з правилами ІЮПАК, концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або її маси до обсягу розчину (моль/л, г/л), тобто це співвідношення неоднорідних величин. Ті величини, які є відношенням однотипних величин (відношення маси розчиненої речовини до маси розчину, відношення об'єму розчиненої речовини до об'єму розчину) правильно називати частками.
Однак на практиці для обох видів виразу складу застосовують термін концентрація
- Концентрація - Величина, що характеризує кількісний склад розчину. Згідно з правилами ІЮПАК, концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або її маси до обсягу розчину (моль/л, г/л), тобто це співвідношення неоднорідних величин. Ті величини, які є відношенням однотипних величин (відношення маси розчиненої речовини до маси розчину, відношення об'єму розчиненої речовини до об'єму розчину) правильно називати частками. Однак на практиці для обох видів виразу складу застосовують термін концентрація і говорять про концентрацію розчинів.

Способи вираження концентрації розчинів
- 1 Масова частка (вагові відсотки,
відсоткова концентрація)
- 2 Об'ємна частка
- 3 Молярність (молярна концентрація)
- 4 Мольна частка
- 5 Моляльність (моляльна концентрація)
- 6 Титр розчину
- 7 Нормальність (молярна концентрація еквівалента)
- 8 Розчинність речовини

Процентна концентрація, масова частка розчиненої речовини
Масова частка розчиненої речовини - це відношення маси розчиненої речовини до маси розчину.
Для розрахунку процентної концентрації використовується формула:
Розчин складається з розчиненої речовини та розчинника. Масу розчину можна визначити за формулою:


Залежність щільності розчинів H 2 SO 4 від масової частки у водному розчині при 20°C
ρ H 2 SO 4 , г/мл

Об'ємна частка
Об'ємна частка - відношення об'єму розчиненої речовини до об'єму розчину. Об'ємна частка вимірюється у частках одиниці чи у відсотках.
де: V (в-ва) – обсяг розчиненої речовини, л;
V(р-ра) – загальний обсяг розчину, л.
Як було зазначено вище, існують ареометри, призначені визначення концентрації розчинів певних речовин. Такі ареометри проградуйовані над значеннях щільності, а безпосередньо концентрації розчину.
V(в-ва)

Молярність (Молярна концентрація)
Молярність – число молейрозчиненого
речовини в одиниці об'єму розчину
де - кількість розчиненої речовини, моль;
V - об'єм розчину, л
Молярність частіше виражають у моль/л або ммоль/л. Можливі такі позначення молярної концентрації - З, См, М.
Так, розчин із концентрацією 0,5 моль/л називають 0,5-молярним (0,5М).

Мольна частка
Мольна частка (X) - відношення кількості молей даного компонента до кількості молей всіх компонентів. Мольну частку виражають у частках одиниці.
X = ν (в-ва) \ ∑ ν (в-в)
ν - кількість компонента, моль;
∑ ν - сума кількостей всіх компонентів,

Моляльність (Моляльна концентрація)
Моляльність – кількість молей розчиненої речовини в 1кг
розчинника.
Вимірюється в моль/кг, Так, розчин з концентрацією
0,5 моль/кг називають 0,5-мольним.
Св = ν / m (р-ля),
де: - кількість розчиненої речовини, моль;
m (р-ля) – маса розчинника, кг.
Слід звернути особливу увагу, що незважаючи на схожість назв, молярність та моляльність величини різні. Насамперед, при вираженні концентрації в моляльності, на відміну молярності, розрахунок ведуть на масу розчинника , а не на об'єм розчину. Моляльність, на відміну молярності, залежить від температури.

Титр розчину
Титр розчину - маса розчиненої речовини
1 мл розчину.
Т = m (в-ва) / V (р-ра),
де: m (в-ва) – маса розчиненої речовини, г;
V(р-ра) – загальний обсяг розчину, мл;
В аналітичній хімії зазвичай концентрацію титранта перераховують стосовно конкретної реакції титрування таким чином, щоб обсяг використаного титранта безпосередньо показував масу визначається речовини; тобто титр розчину показує, якій масі речовини, що визначається (в грамах) відповідає 1 мл титрованого розчину.

Нормальність (молярна концентрація еквівалента)
Нормальність (Сн)- Число еквівалентів даної речовини в одному літрі розчину. Нормальність виражають у моль-екв/л. Часто концентрацію таких розчинів виражають як н. Наприклад, розчин, що містить 0,1 моль-екв/л, називають децинормальним і записують як 0,1н.
Сн = Е/V (р-ра), де:
Е – еквівалент, моль-екв;
V – загальний обсяг розчину, л;
Сн(луги) ∙V(луги)= Сн(кислоти)∙ V(кислоти)

Коефіцієнт розчинності
Дуже часто концентрацію насиченого розчину, поряд з перерахованими характеристиками, виражають через так званий коефіцієнт розчинностіабо просто розчинністьречовини.
Відношення маси речовини, що утворює насичений розчин при даній температурі, до маси розчинника називають коефіцієнтом розчинності :
Кр = m (в-ва) / m (р-ля)
Розчинність речовинипоказує максимальну масу речовини, яка може розчинитися в 100 г розчинника:
р = (m в-ва / m р-ля) ∙ 100%

1.Визначте молярну концентрацію хлориду натрію в 24% розчині його щільністю
1,18 г/мл. (відповідь - 4,84 М)
2. Визначте молярну концентрацію соляної кислоти в 20% розчині щільністю 1,098. (Відповідь - 6М)
3. Визначте молярну концентрацію азотної кислоти в 30% розчині її щільністю 1,18 г/мл. (відповідь - 5,62 М)
4. Обчисліть масову частку гідроксиду калію у водному розчині з концентрацією 3М та щільністю 1,138 г/мл. (Відповідь - 15%)
5. Скільки мл 56% розчину сірчаної кислоти (щільність-1,46г/мл) потрібно для приготування 3 л 1М розчину? (Відповідь – 360 мл)

- 6. До води масою 200 г долили 2М розчин калію хлориду об'ємом 40 мл і щільністю 1,09 г/мл. Визначте молярну концентрацію та масову частку солі в отриманому розчині, якщо його щільність дорівнювала 1,015 г/мл. (відповідь – 0,33М, 2,45%)
- 7. Скільки г гідроксиду калію потрібно для нейтралізації 300 мл 0,5 М розчину сірчаної кислоти? (Відповідь – 16,8 г)
- 8. Який об'єм 2 М розчину гідроксиду калію вступить у реакцію: а) з 49 г сірчаної кислоти; б) з 200 г 24,5%-ного розчину сірчаної кислоти? В) із 50 г 6,3%-ного розчину азотної кислоти?
- 9. Який об'єм 3М розчину хлориду натрію щільністю 1,12 г/мл треба прилити до води масою 200 г, щоб одержати розчин із масовою часткою солі 10%? (Відповідь – 315 мл)
- 10. Який обсяг 3М розчину хлориду калію знадобиться для приготування 200 мл 8%-ного розчину солі із щільністю 1,05 г/мл? (Відповідь – 75,2 мл)
- 11. 2,8 л аміаку розчинили у воді, об'єм розчину довели до 500 мл. Яка кількість речовини аміаку міститься в 1 л такого розчину? (Відповідь – 0,25 моль)
Тема урока. Способи вираження складу розчину. Відсоткова концентрація
Завдання: Ви повинні вирішувати задачі із застосуванням формули для розрахунку ω%, ρ розчину.
Теорія, величини, одиниці виміру, розрахункові формули.
Будь-який розчин має масу ( m розчину), яка складається з маси розчинника та маси розчиненої речовини:
m розчину = m розчинника + m речовини
Будь-який розчин має густину (ρ), яка вимірюється експериментально за допомогою ареометра.
Будь-який розчин займає певний об'єм (V), який вимірюється за допомогою мірного циліндра або іншого мірного посуду.
Для вирішення завдань застосовується формула:
Вправи:
У 630г води розчинили 70г кухонної солі. Яка: а) маса розчинника; б) маса розчиненої речовини; в) маса розчину?
У мірний циліндр налили 500мл розчину, ареометром визначили щільність, рівну 1,1г/мл. Яка маса розчину?
Яку масу має розчин густиною 1,19г/мл об'ємом 100мл?
Розчини відрізняються один від одного вмістом розчиненої речовини (концентрацією).
Відсоткова концентрація (масова частка розчиненої речовини) показує, яка маса речовини розчинена в 100г розчину, обчислюється за формулою:
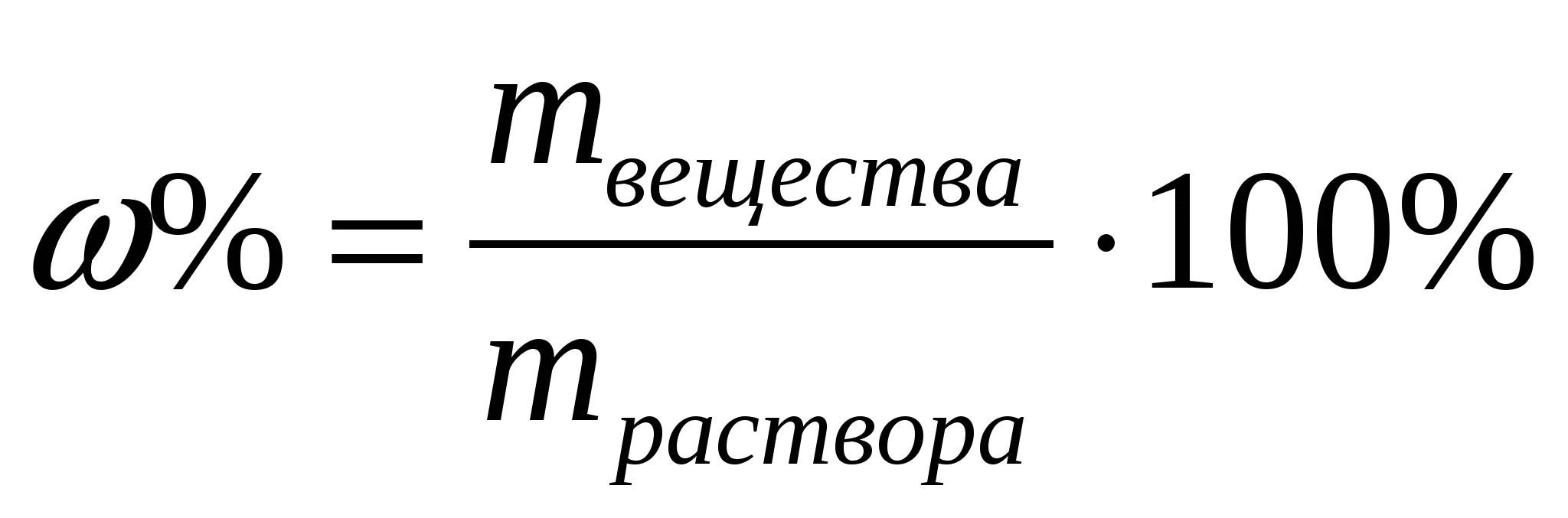
Завдання:
Яку масу кухонної солі ( NaCl) та води треба взяти для приготування розчину з масовою часткою NaCl 8% масою 250г?
Яку масу цукру (З 12 Н 22 Про 11) та води треба взяти для приготування розчину масою 50 г з масовою часткою 0,12?
Визначте масу соди ( Na 2 CО 3) та масу води, необхідні для приготування 280г 5%-ного розчину соди.
При випаровуванні 25г розчину кухонної солі одержали 0,25г солі. Визначте масову частку розчиненої речовини у вихідному розчині.
Яка маса хлориду калію потрібна для приготування 500мл розчину з часткою хлориду калію 16%? Щільність розчину дорівнює 1,1 г/мл.
При вирішенні завдань на змішування розчинів різної концентрації слід пам'ятати про правило: маси вихідних розчинів ставляться один до одного як різниці між концентрацією отриманого розчину та концентраціями вихідних:

Завдання:
Визначте масу розчину з масовою часткою NaCl 10% та масу води, які потрібні для приготування розчину масою 500г з масовою часткою NaCl 2%.
У лабораторії є розчини з масовою часткою сірчаної кислоти 10% та 20%. Яку масу кожного розчину треба взяти для одержання розчину масою 300г із масовою часткою 12%?
Змішали 20% та 32% розчини деякої речовини. Отриманий розчин має масу 150г та масову частку розчиненої речовини 24%. Визначте масу кожного з вихідних розчинів.
Молярна концентрація розчину показує, скільки речовини розчинено в 1л розчину. Розраховується за формулою:

Завдання:
У воді розчинили гідроксид калію (КОН) масою 11,2г, об'єм розчину довели до 200мл. Визначте молярну концентрацію одержаного розчину.
Визначте молярну концентрацію розчину, отриманого при розчиненні сульфату натрію масою 42,6г у воді масою 300г, якщо густина розчину 1,12г/мл.
Яка маса хлориду калію буде потрібна для приготування розчину цієї солі об'ємом 300мл, з концентрацією 0,15М хлориду калію?
Який об'єм розчину з масовою часткою сірчаної кислоти 9,3% (щільність 1,05г/мл) буде потрібно для приготування розчину 0,35М сірчаної кислоти об'ємом 40мл?
Завдання щодо рівняння реакцій:
У 50г розчину сірчаної кислоти поклали шматочок цинку масою 10г. коли реакція припинилася, то виявилося, що 3,5 г цинку залишилося надлишку? Обчисліть відсоткову концентрацію розчину сірчаної кислоти?
У 500 мл води кинули шматочок натрію масою 4,6 г. Обчисліть масову частку розчину лугу.
Яку масу оксиду сірки (VI) треба розчинити у воді масою 4 кг для одержання розчину з масовою часткою сірчаної кислоти 4,9%?
Визначте масову частку гідроксиду барію в розчині, отриманому при змішуванні води масою 50г та оксиду барію масою 1,2г.
Яка маса цинку може прореагувати із соляною кислотою об'ємом 50мл та щільністю 1,1г/мл, масова частка соляної кислоти в якому становить 0,2? Який обсяг водню виділиться при цьому?
Визначте речовину, що утворюється, і її масову частку в розчині, якщо 0,2моль оксиду натрію розчинити в 100г води.
Визначте масу оксиду міді ( II ), яка може розчинитися в 49%-ному розчині сірчаної кислоти масою 400г.
В результаті змішування 200г 4,9% розчину сірчаної кислоти і 200г 4% розчину гідроксиду натрію протікає реакція нейтралізації. Розрахуйте масу солі, що утворилася.
При взаємодії розчину гідроксиду калію об'ємом 500мл концентрацією 0,2моль/л і 10%-ного розчину азотної кислоти масою 200г утворюється сіль. Розрахуйте її масу.
Визначте масу розчину сірчаної кислоти з масовою часткою 0,49, необхідну реакції з гідроксидом алюмінію 7,8г.



