У молекулах алкенів основні зв'язки. Взаємодія алкінів із основами
Найпростішими органічними сполуками є граничні та ненасичені вуглеводні. До них відносять речовини класу алканів, алкінів, алкенів.
Формули їх включають атоми водню та вуглецю у певній послідовності та кількості. Вони часто зустрічаються у природі.
Визначення алкенів
Інша їхня назва - олефіни або вуглеводні етиленові. Саме так назвали цей клас сполук у 18 столітті при відкритті маслянистої рідини – хлористого етилену.
До алкенів відносяться речовини, що складаються з водневих та вуглецевих елементів. Вони відносяться до ациклічних вуглеводнів. У їх молекулі є єдиний подвійний (ненасичений) зв'язок, що з'єднує два вуглецевих атоми між собою.
Формули алкенів
Кожен клас сполук має своє хімічне позначення. Вони символами елементів періодичної системи вказується склад і структура зв'язку кожної речовини.

Загальна формула алкенів позначається так: C n H 2n , де число n більше або дорівнює 2. При її розшифровці видно, що на кожен атом вуглецю припадає по два атоми водню.
Молекулярні формули алкенів з гомологічного ряду представлені наступними структурами: C2H4, C3H6, C4H8, C5H10, C6H12, C7H14, C8H16, C9H18, C 10 H 20 . Видно, що кожен наступний вуглеводень містить один більше вуглецю і на 2 більше водню.
Існує графічне позначення розташування та порядку хімічних сполук між атомами в молекулі, яке показує формула алкенів структурна. За допомогою валентних рисок позначається зв'язок вуглецю з воднями.
Формула алкенів структурна може бути зображена у розгорнутому вигляді, коли показуються всі хімічні елементи та зв'язки. При більш короткому вираженні олефінів не є сполука вуглецю і водню з допомогою валентних рис.
Формою скелетної позначають найпростішу структуру. Ламаною лінією зображують основу молекули, в якій атоми вуглецю представлені її верхівками та кінцями, а ланками вказують водень.
Як утворюються найменування олефінів
CH 3 -HC=CH 2 + H 2 O → CH 3 -OHCH-CH 3 .
При дії на алкени кислотою сірчаною відбувається процес сульфування:
CH 3 -HC=CH 2 + HO-OSO-OH → CH 3 -CH 3 CH-O-SO 2 -OH.
Реакція протікає з утворенням кислих ефірів, наприклад ізопропілсерної кислоти.
Алкени схильні до окислення під час їх спалювання при дії кисню з формуванням води та газу вуглекислого:
2CH 3 -HC=CH 2 + 9O 2 → 6CO 2 + 6H 2 O.
Взаємодія олефінових сполук та розведеного калію перманганату у формі розчину призводить до виникнення гліколів або спиртів двоатомної будови. Ця реакція також є окислювальною з утворенням етиленгліколю та знебарвленням розчину:
3H 2 C=CH 2 + 4H 2 O+ 2KMnO 4 → 3OHCH-CHOH+ 2MnO 2 +2KOH.
Молекули алкенів можуть бути задіяні в процесі полімеризації з вільнорадикальним або катіонно-аніонним механізмом. У першому випадку під впливом пероксидів виходить полімер типу поліетилену.
За другим механізмом катіонними каталізаторами виступають кислоти, а аніонними є металорганічні речовини з виділенням стереоселективного полімеру.
Що таке алкани
Їх ще називають парафінами чи граничними ациклічними вуглеводнями. Вони мають лінійну або розгалужену структуру, в якій містяться тільки насичені прості зв'язки. Усі представники цього класу мають загальну формулу C n H 2n+2 .

У їхньому складі присутні лише атоми вуглецю та водню. Загальна формула алкенів утворюється з позначення граничних вуглеводнів.
Назви алканів та їх характеристика
Найпростішим представником цього класу є метан. За ним йдуть речовини типу етану, пропану та бутану. В основі їх назви лежить корінь чисельного грецькою мовою, до якого додають суфікс -ан. Найменування алканів занесено до IUPAC номенклатури.
Загальна формула алкенів, алкінів, алканів включає лише два різновиди атомів. До них відносяться елементи вуглецю та водню. Кількість вуглецевих атомів у всіх трьох класах збігається, відмінність спостерігається лише у чисельності водню, який може відщеплюватись або приєднуватися. З одержують ненасичені сполуки. У представників парафінів у молекулі міститься на 2 атоми водню більше, ніж у олефінів, що підтверджує загальна формула алканів, алкенів. Алкенова структура вважається ненасиченою за рахунок наявності подвійного зв'язку.
Якщо співвіднести число во-до-ро-дних і уг-ле-ро-дних атомів в ал-ка-нах, то значення буде мак-си-маль-ним у порівнянні з іншими класами уг-ле-во-до -Ро-дов.
Починаючи з метану і закінчуючи бутаном (від 1 до 4), речовини існують в газоподібному вигляді.
У рідкій формі представлені вуглеводні гомологічного проміжку від 5 до 16 . Починаючи з алкану, що має в основному ланцюгу 17 атомів вуглецю, відбувається перехід фізичного стану у тверду форму.
Їх характерна ізомерія по вуглецевому скелету і оптичні видозміни молекули.

У парафінах вуглецеві ва-лент-ності вважаються повністю за-ня-тими сусідніми уг-ле-ро-да-ми або во-до-ро-да-ми з утворенням зв'язку σ-типу. З хімічної точки зору це обумовлює їх слабкі властивості, саме тому алкани носять назву пре-дель-ни-х або на-си-щен-ни-х уг-ле-во-до-ро- дов, позбавлених спорідненості.
Вони вступають у реакції заміщення, пов'язані з галогенуванням за радикальним типом, сульфохлоруванням або нітруванням молекули.
Парафіни піддаються процесу окислення, горіння або розкладання за високих температур. Під дією прискорювачів реакцій відбувається відщеплення атомів водню або дегідрування алканів.
Що таке алкіни
Їх ще називають ацетиленовими вуглеводнями, у яких у вуглецевому ланцюжку присутній потрійний зв'язок. Структура алкінів описується загальною формулою C n H 2 n-2. З неї видно, що на відміну від алканів, у ацетиленових вуглеводнів бракує чотирьох атомів водню. Їх замінює потрійний зв'язок, утворений двома π-з'єднаннями.
Така будова зумовлює хімічні властивості цього класу. Структурна формула алкенів і алкінів наочно показує ненасиченість їх молекул, а також наявність подвійного (H 2 C∡CH 2) і потрійного (HC≡CH) зв'язку.
Найменування алкінів та їх характеристика
Найпростішим представником є ацетилен або HC≡CH. Його також називають етином. Походить воно від назви насиченого вуглеводню, в якому видаляють суфікс -ан і додають -ін. У найменуваннях довгих алкінів цифрою вказують розташування потрійного зв'язку.
Знаючи будову вуглеводнів насичених і ненасичених, можна визначити, під якою літерою позначено загальну формулу алкінів: а) CnH2n; в) CnH2n+2; c) CnH2n-2; г) CnH2n-6. Правильною відповіддю буде третій варіант.
Починаючи з ацетилену і закінчуючи бутаном (від 2 до 4), речовини мають газоподібну природу.

У рідкій формі знаходяться вуглеводні гомологічного проміжку від 5 до 17 . Починаючи з алкіну, що має в основному ланцюгу 18 атомів вуглецю, відбувається перехід фізичного стану у тверду форму.
Для них характерна ізомерія за вуглецевим скелетом, за становищем потрійного зв'язку, а також міжкласові видозміни молекули.
За хімічними характеристиками ацетиленові вуглеводні подібні до алкенів.
Якщо у алкінів потрійний зв'язок кінцевий, то вони виконують функцію кислоти з утворенням солей алкінідів, наприклад, NaC≡CNa. Наявність двох π-зв'язків робить молекулу ацетилідину натрію сильним нуклеофілом, що вступає у реакції заміщення.
Ацетилен піддається хлоруванню в присутності хлориду міді з отриманням дихлорацетилену, конденсації під дією галогеналкінів із виділенням діацетиленових молекул.
Алкіни беруть участь у реакціях принцип яких лежить в основі галогенування, гідрогалогенування, гідротації та карбонілювання. Однак такі процеси протікають слабше, ніж у алкенів із подвійним зв'язком.
Для ацетиленових вуглеводнів можливі реакції приєднання за нуклеофільним типом молекули спирту, первинного аміну або сірководню.
Пі-зв'язок, що містять, - це ненасичені вуглеводні. Вони є похідними алканів, у молекулах яких відбулося відщеплення двох атомів водню. Вільні валентності, що утворилися, формують новий тип зв'язку, який розташовується перпендикулярно площині молекули. Так виникає нова група сполук – алкени. Фізичні властивості, отримання та застосування речовин цього класу у побуті та промисловості ми розглянемо у цій статті.
Гомологічний ряд етилену
Загальна формула всіх сполук, званих алкенами, що відображає їх якісний та кількісний склад, - це C n H 2 n . Назви вуглеводнів за систематичною номенклатурою мають такий вигляд: у терміні відповідного алкану змінюється суфікс з -ан на -ен, наприклад: етан - етен, пропан - пропен і т. д. У деяких джерелах можна зустріти ще одну назву сполук цього класу - олефіни. Далі ми вивчимо процес утворення подвійного зв'язку та фізичні властивості алкенів, а також визначимо їхню залежність від будови молекули.
Як утворюється подвійний зв'язок
Електронну природу пи-зв'язку з прикладу етилену можна наступним чином: атоми карбону у його молекулі перебувають у формі sp 2 -гібридизації. І тут формується сигма-зв'язок. Ще дві гібридні орбіталі – по одній від атомів вуглецю, формують прості сигма-зв'язки з водневими атомами. Два вільних гібридних хмари атомів карбону, що залишилися, перекриваються над і під площиною молекули - утворюється пі-зв'язок. Саме вона визначає фізичні та хімічні властивості алкенів, про які йдеться далі.

Просторова ізомерія
Сполуки, що мають той самий кількісний і якісний склад молекул, але різна просторова будова, називаються ізомерами. Ізомерія зустрічається у групі речовин, званих органічними. На характеристику олефінів впливає явище оптичної ізомерії. Вона виявляється у тому, що гомологи етилену, що містять у кожного з двох вуглецевих атомів при подвійному зв'язку різні радикали або замісники, можуть зустрічатися у формі двох оптичних ізомерів. Вони відрізняються один від одного положенням заступників у просторі щодо площини подвійного зв'язку. Фізичні властивості алкенів у разі також будуть різними. Наприклад, це стосується температур кипіння та плавлення речовин. Так, олефіни нерозгалуженої будови вуглецевого скелета мають вищі температури кипіння, ніж сполуки-ізомери. Також температури кипіння цис-ізомерів алкенів вище, ніж трансізомерів. Щодо температур плавлення картина протилежна.
Порівняльна характеристика фізичних властивостей етилену та його гомологів
Перші три представники олефінів є газоподібними сполуками, потім, починаючи з пентена C 5 H 10 і до алкену з формулою C 17 H 34 - рідини, а далі йдуть тверді речовини. У гомологів етену простежується така тенденція: температури кипіння сполук знижуються. Наприклад, у етилену цей показник дорівнює -169,1°C, а у пропілену -187,6°C. Проте температури кипіння зі збільшенням молекулярної маси підвищуються. Так, у етилену вона дорівнює -103,7 ° C, а у пропіна -47,7 ° C. Підсумовуючи сказаного, можна дійти невтішного висновку, звучить коротко: фізичні властивості алкенів залежить від своїх молекулярної маси. З її збільшенням змінюється агрегатний стан сполук у бік: газ - рідина - тверда речовина, і навіть знижується температура плавлення, а температури кипіння зростають.

Характеристика етену
Перший представник гомологічного ряду алкенів – це етилен. Він є газом, малорозчинним у воді, але добре розчиняється в органічних розчинниках, які не мають кольору. Молекулярна маса - 28, етен трохи легший за повітря, має ледве вловимий солодкуватий запах. Він легко входить у реакції з галогенами, воднем та галогеноводородами. Фізичні властивості алкенів та парафінів проте досить близькі. Наприклад, агрегатний стан, здатність метану та етилену до жорсткого окислення тощо. буд. Як же можна розрізнити алкени? Як виявити ненасичений характер олефіну? Для цього існують якісні реакції, на яких ми зупинимося докладніше. Нагадаємо, яку особливість у будові молекули мають алкени. Фізичні та хімічні властивості цих речовин визначаються наявністю у їхньому складі подвійного зв'язку. Щоб довести її присутність, пропускають газоподібний вуглеводень через фіолетовий розчин калію перманганату або бромну воду. Якщо вони знебарвилися, отже, з'єднання містить у складі молекул пі-зв'язку. Етилен входить у реакцію окислення і знебарвлює розчини KMnO 4 і Br 2 .
Механізм реакцій приєднання
Розрив подвійного зв'язку закінчується приєднанням до вільних валентностей карбону атомів інших хімічних елементів. Наприклад, при взаємодії етилену з воднем, що називається гідрогенізацією, виходить етан. Необхідний каталізатор, наприклад, порошкоподібний нікель, паладій або платина. Реакція з HCl закінчується утворенням хлоретану. Алкени, що містять понад два атоми вуглецю у складі своїх молекул, проходять реакцію приєднання галогеноводородів з урахуванням правила В. Марковникова.

Як гомологи етену взаємодіють із галогеноводородами
Якщо маємо завдання " Охарактеризуйте фізичні властивості алкенів та його отримання " , нам слід розглянути правило У. Марковникова докладніше. Практичним шляхом встановлено, що гомологи етилену реагують з хлороводнем та іншими сполуками за місцем розриву подвійного зв'язку, підкоряючись певній закономірності. Вона полягає в тому, що атом водню приєднується до гідрогенізованого вуглецевого атома, а іон хлору, брому або йоду - до карбонового атома, що містить найменшу кількість атомів водню. Ця особливість перебігу реакцій приєднання одержала назву правила В. Марковникова.
Гідратація та полімеризація
Продовжимо далі розглядати фізичні властивості та застосування алкенів на прикладі першого представника гомологічного ряду – етену. Його реакція взаємодії з водою використовується у промисловості органічного синтезу та має важливе практичне значення. Вперше процес було проведено ще ХІХ столітті А.М. Бутлеровим. Реакція вимагає виконання низки умов. Це, перш за все, використання концентрованої сірчаної кислоти або олеуму як каталізатор і розчинник етену, тиск порядку 10 атм і температура в межах 70°. Процес гідратації відбувається у дві фази. Спочатку за місцем розриву пі-зв'язку до етену приєднуються молекули сульфатної кислоти, при цьому утворюється етилсерна кислота. Потім отримана речовина реагує з водою, виходить етиловий спирт. Етанол - важливий продукт, що застосовується в харчовій промисловості для одержання пластмас, синтетичних каучуків, лаків та інших продуктів органічної хімії.

Полімери на основі олефінів
Продовжуючи вивчати питання застосування речовин, що належать до класу алкенів, вивчимо процес їх полімеризації, в якому можуть брати участь сполуки, що містять ненасичені хімічні зв'язки у складі своїх молекул. Відомо кілька типів реакції полімеризації, якими відбувається утворення високомолекулярних продуктів - полімерів, наприклад таких як поліетилен, поліпропілен, полістирол і т. д. Вільнорадикальний механізм призводить до отримання поліетилену високого тиску. Це одна з найбільш широко застосовуваних сполук у промисловості. Катіонно-іонний тип забезпечує отримання полімеру стереорегулярної будови, наприклад полістиролу. Він вважається одним із найбільш безпечних та зручних у використанні полімерів. Вироби з полістиролу стійкі до агресивних речовин: кислот та лугів, негорючі, легко забарвлюються. Ще один вид механізму полімеризації - димеризація, він призводить до отримання ізобутену, що застосовується як антидетонаційна добавка до бензину.
Способи отримання
Алкени, фізичні властивості яких ми вивчаємо, отримують у лабораторних умовах та промисловості різними методами. У дослідах у шкільному курсі органічної хімії використовують процес дегідратації етилового спирту за допомогою водовіднімних засобів, наприклад, таких як п'ятиокис фосфору або сульфатна кислота. Реакція проводиться при нагріванні та є зворотною процесу отримання етанолу. Ще один поширений спосіб отримання алкенів знайшов своє застосування в промисловості, а саме: нагрівання граничних галогенопохідних вуглеводнів, наприклад хлорпропану з концентрованими спиртовими розчинами лугів - гідроксиду натрію або калію. У реакції відбувається відщеплення молекули хлороводню, за місцем появи вільних валентностей атомів карбону утворюється подвійний зв'язок. Кінцевим продуктом хімічного процесу буде олефін – пропен. Продовжуючи розглядати фізичні властивості алкенів, зупинимося на головному процесі одержання олефінів – піролізі.

Промислове виробництво ненасичених вуглеводнів ряду етилену
Дешева сировина - гази, що утворюються в процесі крекінгу нафти, є джерелом отримання олефінів у хімічній промисловості. Для цього застосовують технологічну схему піролізу - розщеплення газової суміші, що йде з розривом вуглецевих зв'язків та утворенням етилену, пропіну та інших алкенів. Піроліз проводять у спеціальних печах, що складаються з окремих пірозмійників. Вони створюється температура порядку 750-1150°C і є водяна пара як розріджувача. Реакції відбуваються за ланцюговим механізмом, що йде з утворенням проміжних радикалів. Кінцевий продукт - це етилен або пропен, їх одержують у великих обсягах.

Ми докладно вивчили фізичні властивості, а також застосування та способи одержання алкенів.
Для алкенів характерні насамперед реакції приєднанняз подвійного зв'язку. В основному ці реакції йдуть за іонним механізмом. Пі-зв'язок розривається, і утворюються дві нові сигма-зв'язки. Нагадаю, що для алканів типовими були реакції заміщення та йшли вони за радикальним механізмом. Приєднуватися до алкенів можуть молекули водню, ці реакції називаються гідрування, молекули води, гідратація, галогени галогенування, галогенводні гідрогалогенування. Але про все по порядку.
Реакції приєднання з подвійного зв'язку
Отже, першехімічна властивість - здатність приєднувати галогеноводороди, гідрогалогенування.
Пропен та інші алкени реагують з галогеноводородами за правилом Марковникова.

Атом водню приєднується до найбільш гідрованого, або правильніше сказати гідрогенізованого атома вуглецю.
Другимномером у нашому списку властивостей буде гідратація, приєднання води.
Реакція проходить при нагріванні в присутності кислоти зазвичай сірчаної або фосфорної. Приєднання води відбувається також за правилом Марковникова, тобто первинний спирт можна отримати лише гідратацією етилену, решта нерозгалужених алкенів дає вторинні спирти.
І для гідрогалогеніювання та для гідратації існують винятки з правила Марковникова. По-перше, проти цього правила приєднання протікає у присутності пероксидів.
По-друге, для похідних алкенів, у яких є електронноакцепторні групи. Наприклад, для 3,3,3-трифторпропену-1.

Атоми фтору за рахунок високої електронегативності відтягують на себе електронну щільність ланцюга сигма-зв'язків. Таке явище називається негативним індуктивним ефектом.

Через це відбувається зміщення рухомих пі-електронів подвійного зв'язку і крайнього атома вуглецю виявляється частковий позитивний заряд, який зазвичай позначається як дельта плюс. Саме до нього і піде негативно заряджений іон брому, а катіон водню приєднається до найменш гідрованого атома вуглецю.
Крім трифторметильної групи негативний індуктивний ефект має, наприклад, трихлорметильна група, нітрогрупа, карбоксильна група та деякі інші.
Цей другий випадок порушення правила Марковникова в ЄДІ зустрічається дуже рідко, але бажано мати його на увазі, якщо ви плануєте скласти іспит на максимальний бал.
Третєхімічна властивість - приєднання молекул галогенів.

Насамперед це стосується брому, оскільки дана реакція є якісною на кратний зв'язок. При пропущенні, наприклад, етилену через бромну воду, тобто розчин брому у воді, що має коричневий колір, відбувається її знебарвлення. Якщо пропускати через бромну воду суміш газів, наприклад, етан і етен, то можна отримати чистий етан без домішки етену, оскільки той залишиться в реакційній колбі у вигляді диброметана, що є рідиною.
Особливо варто відзначити реакцію алкенів у газовій фазі при сильному нагріванні, наприклад, з хлором.
За таких умов протікає реакція приєднання, а реакція заміщення. При чому виключно по альфа-атому вуглецю, тобто атому, що сусідить з подвійним зв'язком. В даному випадку виходить 3-хлорпропен-1. Ці реакції на іспиті зустрічаються нечасто, тому більшість учнів їх не пам'ятає і, як правило, робить помилки.
Четвертимномером йде реакція гідрування, а разом із нею і реакція дегідрування. Тобто приєднання чи відщеплення водню.

Гідрування відбувається за не дуже високої температури на нікелевому каталізаторі. При вищій температурі можливе дегідрування з одержанням алкінів.
П'ятимвластивістю алкенів є здатність до полімеризації, коли сотні та тисячі молекул алкену за рахунок розриву пі-зв'язку та утворення сигма-зв'язків один з одним утворюють дуже довгі та міцні ланцюжки.
У цьому випадку вийшов поліетилен. Зверніть увагу, що в молекулі, що вийшла, кратні зв'язки відсутні. Такі речовини називаються полімерами, вихідні молекули називаються мономерами, фрагмент, що повторюється - це елементарна ланка полімеру, а число n - ступінь полімеризації.
Також можливі реакції отримання інших важливих полімерних матеріалів, наприклад поліпропілену.


Ще один важливий полімер - полівінілхлорид.

Вихідною речовиною для виробництва цього полімеру є хлоретен, тривіальна назва якого вінілхлорид. Оскільки цей ненасичений заступник називається вініл. Часто зустрічається абревіатура на пластмасових виробах ПВХ розшифровується як полівінілхлорид.
Ми обговорили п'ять властивостей, які були реакції приєднання по подвійному зв'язку. Тепер звернемося до реакцій окислення.
Реакції окислення алкенів
Шостехімічна властивість у нашому загальному списку – це м'яке окислення або реакція Вагнера. Воно протікає при дії на алкен водяним розчином перманганату калію на холоду, тому часто в екзаменаційних завданнях вказують температуру нуль градусів.
В результаті виходить двоатомний спирт. В даному випадку етиленгліколь, а загалом такі спирти носять загальну назву гліколі. У процесі реакції фіолетово-рожевий розчин перманганату знебарвлюється, тому ця реакція також якісна на подвійний зв'язок. Марганець у нейтральному середовищі зі ступеня окиснення +7 відновлюється до ступеня окиснення +4. Розглянемо ще кілька прикладів. РІВНЯННЯ
Тут вийшов пропандіол-1,2. Проте так само реагуватимуть і циклічні алкени. РІВНЯННЯ
Ще один варіант, коли подвійний зв'язок знаходиться, наприклад, в бічній ланцюзі ароматичних вуглеводнів. Регулярно у завданнях еге зустрічається реакція Вагнера за участю стиролу, його друга назва вінілбензол.

Я сподіваюся, що до вашої уваги достатньо прикладів, щоб ви зрозуміли, що м'яке окислення подвійного зв'язку завжди підпорядковується досить простому правилу - пі-зв'язок розривається і до кожного атома вуглецю приєднується гідроксигрупа.
Тепер щодо жорсткого окислення. Це буде наше сьомевластивість. Таке окислення відбувається, коли алкен реагує із кислотним розчином перманганату калію при нагріванні.
Відбувається деструкція молекули, тобто її руйнування подвійного зв'язку. У разі бутена-2 вийшли дві молекули оцтової кислоти. У цілому ж, за продуктами окиснення можна судити про становище кратного зв'язку у вуглецевому ланцюзі.
При окисленні бутену-1 виходить молекула пропіонової (пропанової) кислоти та вуглекислий газ.
У разі етилену вийде дві молекули вуглекислого газу. У всіх випадках у кислому середовищі марганець зі ступеня окиснення +7 відновлюється до +2.
І наостанок, восьмевластивість повне окислення або горіння.
Алкени згоряють, як і інші вуглеводні, до вуглекислого газу та води. Запишемо рівняння згоряння алкенів у загальному вигляді.
Молекул вуглекислого газу буде стільки ж, скільки атомів вуглецю в молекулі алкену, оскільки до складу молекули CO 2 входить один атом вуглецю. Тобто n молекул CO2. Молекул води буде вдвічі менше, ніж атомів водню, тобто 2n/2, отже просто n.
Атомів кисню ліворуч і праворуч однакова кількість. Праворуч їх 2n із вуглекислого газу плюс n із води, разом 3n. Зліва атомів кисню стільки ж, отже молекул вдвічі менше, оскільки у складі молекули входять два атома. Тобто 3n/2 молекул кисню. Можна записати 1,5 n.
Ми роздивились вісімхімічні властивості алкенів.
Алкени ненасичені аліфатичні вуглеводні з одним або декількома подвійними вуглець-вуглецевими зв'язками. Подвійний зв'язок перетворює два атоми вуглецю на плоску структуру з валентними кутами між сусідніми зв'язками по 120°С:
Гомологічний ряд алкенів має загальну формулу двома його першими членами є етен (етилен) та пропен (пропілен):

Члени ряду алкенів із чотирма чи більшим числом атомів вуглецю виявляють ізомерію положення зв'язків. Наприклад, алкен з формулою має три ізомери, два з яких є ізомерами положення зв'язків:
Зауважимо, що нумерація ланцюга алкенів проводиться з того кінця, який ближче до подвійного зв'язку. Положення подвійного зв'язку вказується меншим із двох номерів, які відповідають двом атомам вуглецю, пов'язаним між собою подвійним зв'язком. Третій ізомер має розгалужену структуру:

Число ізомерів будь-якого алкену зростає з числом атомів вуглецю. Наприклад, гексен має три ізомери положення зв'язків:
дієнів є бута-1,3-дієн, або просто бутадієн:
Сполуки, що містять три подвійні зв'язки, називаються трієнами. Сполуки з кількома подвійними зв'язками мають загальну назву полієни.
Фізичні властивості
Алкени мають дещо нижчі температури плавлення та кипіння, ніж відповідні їм алкани. Наприклад, пентан має температуру кипіння. Етилен, пропен і три ізомери бутену при кімнатній температурі і нормальному тиску знаходяться в газоподібному стані. Алкени з кількістю атомів вуглецю від 5 до 15 у нормальних умовах перебувають у рідкому стані. Їх леткість, як і в алканів, зростає за наявності розгалуження у вуглецевому ланцюзі. Алкени з числом атомів вуглецю більше 15 за нормальних умов є твердими речовинами.
Отримання у лабораторних умовах
Двома основними способами одержання алкенів у лабораторних умовах є дегідратація спиртів та дегідрогалогенування галогеноалканів. Наприклад, етилен можна отримати дегідратацією етанолу при дії надлишку концентрованої сірчаної кислоти при температурі 170 °С (див. Розд. 19.2):
Етилен також можна отримати з етанолу, пропускаючи пари етанолу над поверхнею нагрітого оксиду алюмінію. Для цього можна використовувати установку, схематично зображену на рис. 18.3.
Другий поширений метод отримання алкенів заснований на проведенні дегідрогалогенування галогеноалканів в умовах основного каталізу
Механізм реакції елімінування такого типу описаний у розд. 17.3.
Реакції алкенів
Алкени мають набагато більшу реакційну здатність, ніж алкани. Це зумовлено здатністю -електронів подвійного зв'язку притягувати електрофіли (див. Розд. 17.3). Тому характерні реакції алкенів є головним чином реакції електрофільного приєднання по подвійному зв'язку:

Багато з цих реакцій мають іонні механізми (див. Розд. 17.3).
Гідрування
Якщо який-небудь алкен, наприклад етилен, змішати з воднем і пропустити цю суміш над поверхнею платинового каталізатора за кімнатної температури або нікелевого каталізатора при температурі близько 150°С, то приєднання
водню по подвійному зв'язку алкену. При цьому утворюється відповідний алкан:

Реакція цього є приклад гетерогенного каталізу. Його механізм описаний у розд. 9.2 та схематично показаний на рис. 9.20.
Приєднання галогенів
Хлор або бром легко приєднуються по подвійному зв'язку алкену; ця реакція протікає в неполярних розчинниках, наприклад, тетрахлорометані або гексані. Реакція протікає за іонним механізмом, що включає утворення карбкатіону. Подвійний зв'язок поляризує молекулу галогену, перетворюючи її на диполь:

Тому розчин брому в гексані або тетрахлорометані під час струшування з алкеном знебарвлюється. Те саме відбувається, якщо струшувати алкен з бромною водою. Бромна вода є розчином брому у воді. Цей розчин містить бромновату кислоту. Молекула бромноватої кислоти приєднується за подвійним зв'язком алкену, і в результаті утворюється бромозаміщений спирт. Наприклад

Приєднання галогеноводородів
Механізм реакції цього описаний в розд. 18.3. Як приклад розглянемо приєднання хлороводню до пропену:
Зазначимо, що продукт цієї реакції є 2-хлоропропан, а не 1-хлоро-пропан:
![]()
У таких реакціях приєднання найбільш електронегативний атом або найбільш електронегативна група завжди приєднуються до атома вуглецю, пов'язаного з
найменшим числом атомів водню. Ця закономірність називається правила Марковникова.
Переважне приєднання електронегативного атома або групи до атома вуглецю, пов'язаного з найменшим числом атомів водню, обумовлено підвищенням стійкості карбкатіону у міру зростання числа алкільних замісників на атомі вуглецю. Це підвищення стійкості пояснюється індуктивним ефектом, що виникає в алкільних групах, оскільки вони є донорами електронів:

У присутності будь-якого органічного пероксиду пропен реагує з бромоводнем, утворюючи не за правилом Марковникова. Такий продукт називається антимарковніковським. Він утворюється в результаті протікання реакції за радикальним, а не іонним механізмом.
Гідратація
Алкени реагують з холодною концентрованою сірчаною кислотою, утворюючи алкіл-гідросульфати. Наприклад

Ця реакція є приєднанням, оскільки в ній відбувається приєднання кислоти по подвійному зв'язку. Вона є зворотною реакцією стосовно дегідратації етанолу з утворенням етилену. Механізм цієї реакції подібний до механізму приєднання галогеноводородів по подвійному зв'язку. Він включає утворення проміжного карбкатіону. Якщо продукт цієї реакції розбавити водою та обережно нагрівати, він гідролізується, утворюючи етанол:
Реакція приєднання сірчаної кислоти до алкенів підпорядковується правилу Марковникова:

Реакція з підкисленим розчином перманганату калію
Фіолетове забарвлення підкисленого розчину перманганату калію зникає, якщо цей розчин струшують у суміші з будь-яким алкеном. Відбувається гідроксилювання алкену (введення до нього гідроксигрупи, що утворюється внаслідок окислення), який у результаті перетворюється на діол. Наприклад, при струшуванні надлишкової кількості етилену з підкисленим розчином відбувається утворення етан-1,2-діолу (етиленгліколю)

Якщо алкен струшують з надмірною кількістю розчину -іонів, відбувається окислювальне розщеплення алкену, що призводить до утворення альдегідів та кетонів:
Альдегіди, що утворюються при цьому, піддаються подальшому окиснення з утворенням карбонових кислот.
Гідроксилювання алкенів з утворенням діолів може проводитися за допомогою лужного розчину перманганату калію.
Реакція з пербензойною кислотою
Алкени реагують з пероксикислотами (надкислотами), наприклад, з пербензойною кислотою, утворюючи прості циклічні ефіри (епоксисполуки). Наприклад

При обережному нагріванні епоксиетану з розведеним розчином будь-якої кислоти утворюється етан-1,2-діол:

Реакції із киснем
Як і всі інші вуглеводні, алкени горять і при рясному доступі повітря утворюють діоксид вуглецю та воду:
При обмеженому доступі повітря горіння алкенів призводить до утворення моноксиду вуглецю та води:
Оскільки алкени мають вищий відносний вміст вуглецю, ніж відповідні алкани, вони горять з утворенням більш димного полум'я. Це пов'язано з утворенням частинок вуглецю:
Якщо змішати алкен з киснем і пропустити цю суміш над поверхнею срібного каталізатора, при температурі близько 200 °С утворюється епоксиетан:
Озоноліз
При пропущенні газоподібного озону через розчин будь-якого алкену в трихлорометані або тетрахлорометані за температури нижче 20 °С утворюється озонид відповідного алкену (оксиран)

Озоніди – нестійкі з'єднання і можуть бути вибухонебезпечними. Вони піддаються гідролізу з утворенням альдегідів чи кетонів. Наприклад

В цьому випадку частина метаналю (формальдегіду) реагує з пероксидом водню, утворюючи метанову (мурашину) кислоту:
Полімеризація
Найпростіші алкени можуть полімеризуватися з утворенням високомолекулярних сполук, які мають ту саму емпіричну формулу, що і вихідний алкен:
Ця реакція протікає при високому тиску, температурі 120°З присутності кисню, який грає роль каталізатора. Однак полімеризацію етилену можна проводити і при нижчому тиску, якщо скористатися каталізатором Циглеру. Одним з найбільш поширених каталізаторів Циглеру є суміш триетилалюмінію та тетрахлориду титану.
Полімеризація алкенів докладніше розглядається в розд. 18.3.
Алкени - клас органічних сполук, що має подвійний зв'язок між атомами вуглецю, структурна формула - C n H 2n . Подвійний зв'язок у молекулах олефінів - це один σ-і один π-зв'язок. Таким чином, якщо ми представимо два атоми вуглецю і розмістимо їх на площині, σ-зв'язок буде розташований на площині, а π-зв'язок буде розташовуватися вище і нижче площини (якщо Ви погано уявляєте собі, про що йдеться, зверніться до розділу хімічні зв'язки ).
Гібридизація
В алкенах має місце sp 2 -гібридизація, для якої кут H-C-H становить 120 градусів, а довжина зв'язку C = C дорівнює 0134 нм.
Будова
З наявності π-зв'язку випливає, і експериментально підтверджується, що:
- За своєю будовою подвійний зв'язок у молекулах алкенів більш сприйнятливий до зовнішнього впливу, ніж звичайний σ-зв'язок
- Подвійний зв'язок унеможливлює обертання навколо σ-зв'язку, звідки слідує наявність ізомерів, дані ізомери називаються цис- і транс-
- π-зв'язок менш міцний, ніж σ-зв'язок, оскільки електрони знаходяться далі від центрів атомів
Фізичні властивості
Фізичні властивості алкенів схожі на фізичні властивості алканів. Алкени, що мають до п'яти атомів вуглецю, перебувають у газоподібному стані за нормальних умов. Молекули із вмістом від шести до 16 атомів вуглецю перебувають у рідкому стані та від 17 атомів вуглецю - алкени перебувають у твердому стані за нормальних умов.
Температура кипіння алкенів у середньому збільшується на 30 градусів на кожну CH 2 -групу, як і у алканів, відгалуження знижують температуру кипіння речовини.
Наявність π-зв'язку робить олефіни слаборозчинними у воді, що зумовлює їхню невелику полярність. Алкени - неполярні речовини та розчиняються в неполярних розчинниках та слабо полярних розчинниках.
Щільність алкенів вище, ніж у алканів, але нижче, ніж у води
Ізомерія
- Ізомерія вуглецевого скелета: 1-бутен і 2-метилпропен
- Ізомерія положення подвійного зв'язку: 1-бутен та 2-бутен
- Міжкласова ізомерія: 1-бутен та циклобутан
Реакції
Характерні реакції алкенів - реакції приєднання, π-зв'язок розривається і електрони, що утворилися, охоче приймають новий елемент. Наявність π-зв'язку означає більше енергії, тому, зазвичай, реакції приєднання носять екзотермічний характер, тобто. протікають із виділенням тепла.
Реакції приєднання
Приєднання галогенводнів
Галогенводні легко приєднуються до подвійного зв'язку алкенів, формуючи галогеналки лы. Галогенводні змішують з оцтовою кислотою, або безпосередньо, в газоподібному стані, змішують з алкеном. Для розгляду механізму реакції необхідно знати правило Марковникова.
Правило Марковнікова
При взаємодії гомологів етилену з кислотами водень приєднується до більш гідрогенізованого атома вуглецю.
Виняток із правила, гідроборування алкінів, буде розглянуто у статті про алкін.
Механізм реакції приєднання галогенводнів до алкенів наступний: відбувається гомолітичний розрив зв'язку в молекулі галогенводню, утворюється протон та аніон галогену. Протон приєднується до алкену утворюючи карбкатіон, така реакція є ендотермічною і має високий рівень енергії активації, тому реакція відбувається повільно. Утворений каркарбіон дуже реактивний, тому легко зв'язується з галогеном, енергія активації низька, тому цей етап не гальмує реакцію.
При кімнатній температурі алкени реагують із хлором та бромом у присутності тетрахлорметану. Механізм реакції приєднання галогенів виглядає так: електрони з π-зв'язку впливають на молекулу галогену X 2 . У міру наближення галогену до олефіну електрони в молекулі галогену зміщуються до більш віддаленого атома, таким чином молекула галогену поляризується, найближчий атом має позитивний заряд, більш віддалений - негативний. Відбувається гетеролітичний розрив зв'язку в молекулі галогену, утворюється катіон та аніон. Катіон галогену приєднується до двох атомів вуглецю за допомогою електронної пари π-зв'язку та вільної електронної пари катіону. Аніон галогену, що залишився, впливає на один з атомів вуглецю в молекулі галогеналкену розриваючи цикл C-C-X і утворюючи дигалогеналкен.
Реакції приєднання алкенів знаходять два основних застосування, перше – кількісний аналіз, визначення кількості подвійних зв'язків кількістю поглинених молекул X2. Друге – у промисловості. Виробництво пластику засноване на вінілхлорид. Трихлоретилен та тетрахлоретилен - відмінні розчинники ацетиленових жирів та гум.
Гідрування
Приєднання газоподібного водню до алкену відбувається з каталізаторами Pt, Pd чи Ni. Внаслідок реакції утворюються алкани. Основне застосування реакції каталітичного приєднання водню – це, по-перше, кількісний аналіз. За залишком молекул H2 можна визначити кількість подвійних зв'язків у речовині. По-друге, рослинні жири та жири риб є ненасиченими вуглецями і таке гідрування призводить до збільшення температури плавлення, перетворюючи на тверді жири. У цьому процесі засновано виробництво маргарину.
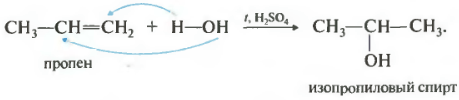
Гідратація
При змішуванні алкенів із сірчаною кислотою утворюються алкіл-гідросульфати. При розведенні алкіл-гідросульфатів водою і супутньому нагріванні утворюється спирт. Приклад реакції - змішування етену (етилен) із сірчаною кислотою, подальше змішування з водою та нагрівання, результат - етанол.
Окислення
Алкени легко окислюються різними речовинами, такими як, наприклад, KMnO 4 O 3 OsO 4 і т.д. Існує два види окислення алкенів: розрив π-зв'язку без розриву σ-зв'язку та розрив σ- та π-зв'язку. Окислення без розриву сигма-зв'язку називається м'яким окисленням, із розривом сигма-зв'язку - жорстким окисленням.
Окислення етену без розриву σ-зв'язку утворює епоксиди (епоксиди - це циклічні сполуки C-C-O) або двоатомні спирти. Окислення з розривом σ-зв'язку утворює ацетони, альдегіди та карбонові кислоти.
Окислення перманганатом калію
Реакції окислення алкенів під впливом перманганату калію називаються були відкриті Єгором Вагнером і носить його ім'я. У реакції Вагнера окислення відбувається в органічному розчиннику (ацетон або етанол) при температурі 0-10°C, у слабкому розчині перманганату калію. В результаті реакції утворюються двоатомні спирти та знебарвлюється перманганат калію.
Полімеризація
Більшість простих алкенів можуть відчувати реакції самоприєднання, формуючи таким чином великі молекули структурних одиниць. Такі великі молекули називаються полімерами, реакція, яка дозволяє отримати полімер називається полімеризацією. Прості структурні одиниці, що утворюють полімери, називають мономерами. Полімер позначається укладанням повторюваної групи в дужках із зазначенням індексу "n", що означає велику кількість повторень, наприклад: "-(CH 2 -CH 2) n -" - поліетилен. Процеси полімеризації – основа виробництва пластику та волокон.
Радикальна полімеризація
Радикальна полімеризація ініціюється за допомогою каталізатора – кисню або пероксиду. Реакція складається з трьох етапів:
Ініціація
ROOR → 2RO.
CH 2 = CH-C 6 H 5 → RO - CH 2 C . H-C 6 H 5
Зростання ланцюга
RO - CH 2 C . H-C 6 H 5 + CH 2 =CH-C 6 H 5 → RO-CH 2 -CH(C 6 H 5)-CH 2 -C . -C 5 H 6
Обрив ланцюга рекомбінацією
CH 2 -C. H-C6H5+CH2-C. H-C 6 H 5 → CH 2 -CH-C 6 H 5 -CH 2 -CH-C 6 H 5
Обрив ланцюга диспропорціонуванням
CH 2 -C. H-C6H5+CH2-C. H-C 6 H 5 → CH=CH-C 6 H 5 + CH 2 -CH 2 -C 6 H 5
Іонна полімеризація
Інший спосіб полімеризації алкенів – це іонна полімеризація. Реакція протікає з утворенням проміжних продуктів – карбкатіонів та карбаніонів. Утворення першого карбкатіону, як правило, здійснюється за допомогою кислоти Льюїса, утворення карбаніону відбувається відповідно при реакції з основою Льюїса.
A + CH 2 = CH-X → A-CH 2 -C + H-X → ... → A-CH 2 -CHX-CH 2 -CHX-CH 2 C + HX ...
B + CH 2 = CH-X → B-CH 2 -C - H-X → ... → B-CH 2 -CHX-CH 2 -CHX-CH 2 C - HX ...
Поширені полімери
Найбільш поширеними полімерами є:
Номенклатура
Назва алкенів, аналогічно алканам, складається з першої частини - префікса, що позначає кількість атомів вуглецю в головному ланцюзі, і суфікса -єн. Алкен - з'єднання з подвійним зв'язком, тому молекули алкену починаються з двох атомів вуглецю. Перший у списку - етен, ет - два атоми вуглецю, - він - наявність подвійного зв'язку.
Якщо в молекулі більше трьох атомів вуглецю, необхідно вказувати позицію подвійного зв'язку, наприклад, бутен може бути двох видів:
CH 2 =CH-CH 2 -CH 3
CH 3 -CH=CH-CH 3
Для позначення позиції подвійного зв'язку, необхідно додати цифру, наприклад вище це будуть 1-бутен і 2-бутен відповідно (також застосовуються назви 1-бутен і 2-бутен, але вони не є систематичними).
Наявність подвійного зв'язку тягне за собою ізомерію, коли молекули можуть перебувати по різні боки від подвійного зв'язку, наприклад:
Ця ізомерія називається цис- (Z-zusammen, з німецької разом) і транс- (E-entgegen, з німецької навпроти), в першому випадку цис-1,2-дихлоретен (або (Z)-1,2-дихлоретен), у другому - транс-1,2-дихлоретен (або (E)-1,2-дихлоретен).



